En el desarrollo y fabricación de medicamentos, especialmente en contextos regulados, como el europeo, cada vez es más habitual externalizar parte del proceso a empresas especializadas. Aquí es donde entran en juego dos figuras clave: las CMO (Contract Manufacturing Organization) y las CDMO (Contract Development and Manufacturing Organization). Aunque a menudo se utilizan indistintamente, su alcance y funciones son distintos, y conocer esa diferencia es esencial para elegir el socio adecuado según el estado del producto y los objetivos de la empresa farmacéutica. Sigue leyendo para conocer qué son los CMOs y CDMO y qué diferencias existen.
¿Qué es CDMO?
Una CDMO (Contract Development and Manufacturing Organization) es una empresa que ofrece servicios integrados de desarrollo y fabricación de medicamentos, abarcando desde la formulación química y el escalado industrial hasta la producción comercial bajo normativas como GMP
Funciones clave:
- Desarrollo de pre‑formulación, métodos analíticos, estabilidad y formulación final de principios activos.
- Escalado de procesos (desde gramos a toneladas) y producción de lotes clínicos y comerciales.
- Soporte regulatorio y transferencia de tecnología.
- Packaging, logística y gestión de la cadena de suministro
Las CDMOs permiten a las empresas farmacéuticas acelerar el lanzamiento al mercado, reducir costes y riesgos, y centrarse en la I+D mientras externalizan las fases técnicas y operativas críticas
¿Qué es CMO?
Una CMO (Contract Manufacturing Organization) se especializa en la fabricación por contrato, enfocándose en la producción de medicamentos ya desarrollados, sin intervenir en la fase de formulación o desarrollo técnico
Funciones clave:
- Producción de APIs, formas sólidas orales, líquidos, inyectables y productos estériles.
- Preformulación mínima y ejecución de procesos validados, incluyendo envasado y etiquetado.
- Aseguramiento de calidad, cumplimiento GMP y trazabilidad
Las CMO son ideales para compañías que ya tienen su producto desarrollado pero necesitan capacidad industrial, flexibilidad en producción o acceso a plantas certificadas.
Principales diferencias entre los fármacos CMOs y CDMO
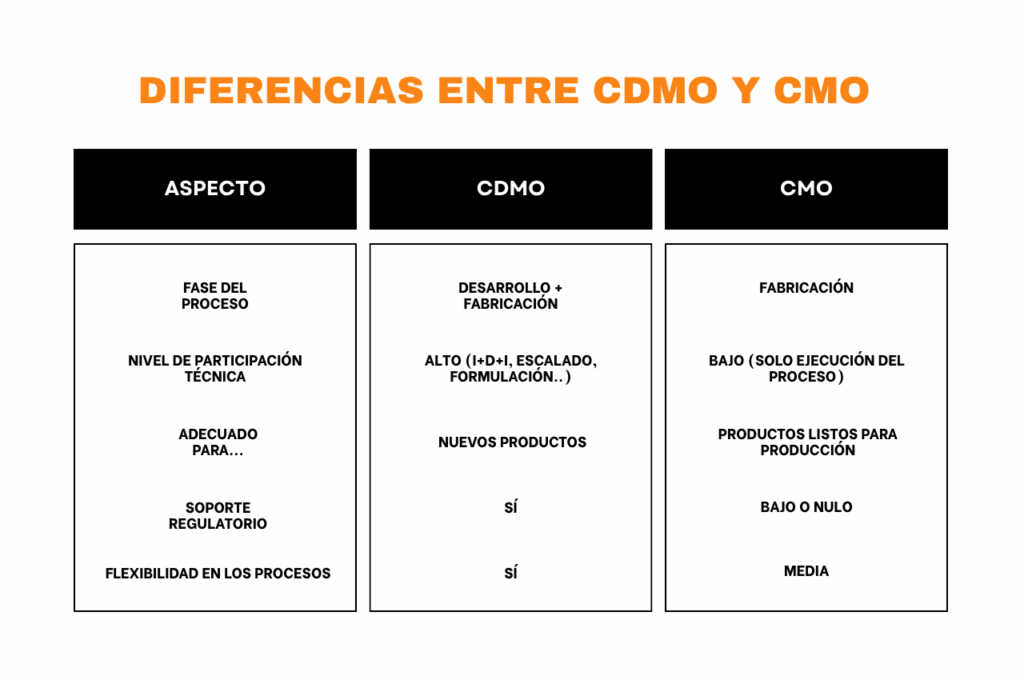
1. Alcance de los servicios
- CDMO: ofrece un servicio integral, que abarca desde el desarrollo preclínico (formulación, optimización de APIs, métodos analíticos) hasta la fabricación industrial bajo GMP, incluyendo escalado, ensayos clínicos y soporte regulatorio
- CMO: se centra exclusivamente en la producción, aceptando formulaciones ya desarrolladas y validadas, sin participar en etapas de I+D.
2. Fase del ciclo de vida del fármaco
- CDMO: está presente desde la fase inicial del proyecto, ayudando a diseñar y optimizar moléculas o formulaciones antes del escalado.
- CMO: interviene en fases posteriores, cuando se requiere producción de lotes clínicos o comerciales, partiendo de una formulación definida.
3. Nivel de involucramiento técnico
- CDMO: aporta expertise técnico completo, desde investigación hasta estrategia regulatoria, gestión de ensayos y transferencia tecnológica.
- CMO: su función técnica se limita a ejecutar procesos validados, garantizando calidad y trazabilidad, pero sin aportar soporte en desarrollo.
4. Beneficios estratégicos
- CDMO: acelera el time-to-market, reduce riesgos financieros al evitar construir capacidades internas, y optimiza costes mediante un modelo “todo en uno”.
- CMO: ofrece flexibilidad en producción, permite acceso a capacidad instalada sin grandes inversiones y es ideal para fases de fabricación pura
5. Transferencia tecnológica y regulatoria
- CDMO: gestiona la transferencia de tecnología, la validación de procesos y el soporte regulatorio para ensayos clínicos y autorización de mercado.
- CMO: suele trabajar con procesos ya homologados, aunque también debe cumplir con normativas GMP y requisitos contractuales del cliente.
Mejores prácticas para garantizar la calidad del producto
Elegir el socio adecuado y aplicar buenas prácticas desde el inicio es fundamental para garantizar la calidad del fármaco, cumplir con la normativa y optimizar tiempos y costes. Algunas recomendaciones:
- Validación de capacidades técnicas: Asegurarse de que el proveedor tiene experiencia en el tipo de producto (oral, inyectable, biológico…) y en la escala deseada.
- Cumplimiento regulatorio: Exigir certificaciones GMP, trazabilidad documental y sistemas de control de calidad robustos.
- Transparencia en procesos: Mantener una comunicación fluida con el proveedor, con acuerdos claros de confidencialidad y propiedad intelectual.
- Tecnologías limpias y eficientes: Optar por soluciones como la extracción con CO₂ supercrítico, especialmente en la fase de desarrollo, permite obtener APIs más puros, sostenibles y adaptados a normativas europeas exigentes.
¿Cuándo puede AINIA actuar como CMO o CDMO?
En AINIA contamos con una amplia experiencia en el desarrollo y la producción de ingredientes activos para el sector farmacéutico, lo que nos permite actuar como socio tanto en modelo CDMO como CMO, en función de las necesidades del cliente.
- Como CDMO, ofrecemos servicios integrales que abarcan desde el diseño y optimización de principios activos (APIs) mediante tecnologías como la extracción con CO₂ supercrítico, hasta el escalado de procesos, caracterización, validación y soporte regulatorio. Esto es especialmente útil en fases tempranas o cuando se requiere un desarrollo adaptado a normativas europeas exigentes.
- Como CMO, colaboramos con empresas que ya han definido su formulación y necesitan un partner que pueda producir de forma segura, eficiente y bajo estándares GMP, incluyendo la fabricación de lotes piloto o industriales a medida.
Gracias a plataformas como ALTEX, y a nuestras capacidades de adaptación a escala y requisitos regulatorios, ofrecemos soluciones flexibles y eficientes, orientadas a la innovación y la sostenibilidad.