Les cultures cellulaires constituent un outil essentiel de la recherche scientifique moderne. Au cours des dernières décennies, les chercheurs ont développé des techniques de culture cellulaire avancées permettant d’isoler des cellules individuelles à partir de tissus et d’obtenir des populations homogènes pouvant être maintenues, manipulées et multipliées in vitro.
Les 4 types de culture cellulaire : définitions, différences et exemples d’application
Il est fondamental de comprendre les différents types de culture cellulaire, car chacun présente des caractéristiques particulières et s’adapte à des objectifs expérimentaux ou productifs spécifiques.
Culture cellulaire primaire
Elles sont obtenues directement à partir d’un tissu ou d’un organe. Elles conservent les caractéristiques originales du tissu d’origine, mais leur capacité de prolifération est limitée. Les cultures primaires sont souvent utilisées aux premières étapes de la recherche et peuvent donner naissance à des cultures secondaires.
Culture cellulaire secondaire – lignées cellulaires
Issues des cultures primaires, elles peuvent être sous-cultivées dans de nouveaux récipients pour être maintenues pendant plusieurs semaines ou mois. Les cultures secondaires permettent non seulement de conserver les cellules sur de longues périodes, mais aussi d’étudier des fonctions spécialisées, telles que l’absorption intestinale ou le métabolisme des composés.
Par exemple, ce type de culture cellulaire peut être appliqué dans des essais in vitro de biodisponibilité, en utilisant des lignées cellulaires intestinales humaines comme Caco-2, afin d’évaluer comment les ingrédients fonctionnels, les nutraceutiques, les composés pharmacologiques ou bioactifs sont absorbés après leur passage dans un digesteur dynamique simulant le processus gastro-intestinal humain.
Lignées cellulaires – cultures continues
Certaines cellules peuvent acquérir la capacité de se diviser indéfiniment, soit par manipulation génétique (introduction de la télomérase ou d’oncogènes), soit spontanément, comme c’est le cas pour de nombreuses cellules de rongeurs. Ces lignées cellulaires sont largement utilisées pour leur stabilité, leur homogénéité et leur facilité de stockage dans l’azote liquide. Elles peuvent également être clonées pour générer des populations génétiquement identiques, ce qui permet par exemple d’étudier des mutations spécifiques.
Hybridomes
Résultant de la fusion entre des lymphocytes B et des cellules tumorales, les hybridomes sont des lignées cellulaires capables de produire des anticorps monoclonaux de manière indéfinie. Cette technologie permet d’obtenir des anticorps hautement spécifiques pour le traitement et la détection de nombreuses pathologies.
Comment les cellules sont-elles obtenues en culture cellulaire ?
La culture cellulaire désigne l’ensemble des techniques permettant de maintenir des cellules vivantes en dehors de l’organisme tout en conservant leurs propriétés physiologiques. Ces cellules peuvent croître en suspension ou en monocouche et sont obtenues à partir de différentes sources biologiques.
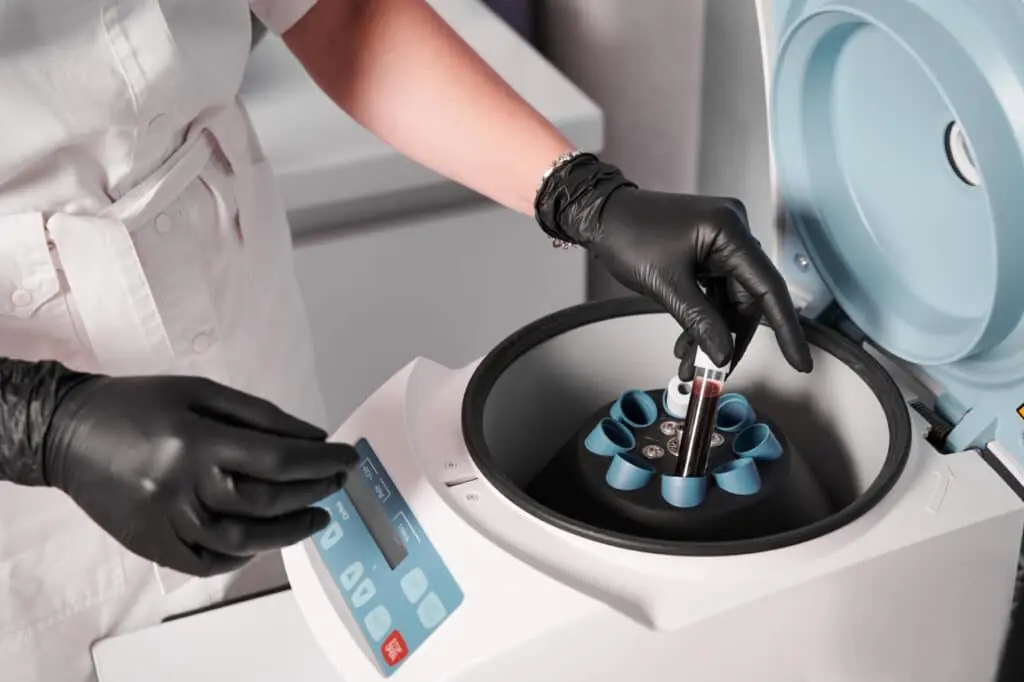
Pour établir une culture à partir d’un tissu, la première étape consiste à isoler les cellules individuelles en les séparant de la matrice extracellulaire qui les relie. Cette opération s’effectue à l’aide d’enzymes protéolytiques et d’agents chélateurs tels que l’EDTA, qui interfèrent avec l’adhésion cellulaire. On obtient ainsi une suspension cellulaire mixte, ensuite purifiée selon le type de cellules souhaité.
Les méthodes les plus courantes pour séparer les types cellulaires comprennent :
- La centrifugation, selon la taille des cellules.
- L’adhérence différentielle au verre ou au plastique.
- L’utilisation d’anticorps spécifiques fixés sur des matrices solides (par exemple, billes de latex ou de collagène).
- Le marquage par anticorps fluorescents suivi d’un tri cellulaire.
- La microdissection laser, utile pour isoler des groupes cellulaires spécifiques à partir de tissus complexes, comme les tumeurs.
Évaluation de la biodisponibilité à l’aide de cultures cellulaires
L’utilisation de modèles de culture cellulaire intestinale humaine, tels que Caco-2, s’est imposée comme un outil avancé pour les essais in vitro de biodisponibilité. Lorsqu’ils sont combinés à des systèmes de digestion gastro-intestinale dynamique, ces modèles permettent de simuler de manière réaliste le processus digestif humain, fournissant des informations détaillées sur la libération, l’absorption et le métabolisme des composés bioactifs.
Cette méthodologie est particulièrement précieuse pour évaluer l’efficacité des ingrédients fonctionnels, des nutraceutiques et des composés pharmacologiques, tout en contribuant à réduire significativement les coûts et les délais de développement aux premières étapes de la recherche.