Dans le développement et la fabrication de médicaments – en particulier dans des contextes réglementés comme celui de l’Union européenne – il est de plus en plus courant d’externaliser une partie du processus à des entreprises spécialisées. C’est dans ce cadre que deux acteurs clés entrent en jeu : les CMO (Contract Manufacturing Organizations) et les CDMO (Contract Development and Manufacturing Organizations). Bien que ces deux termes soient parfois utilisés de manière interchangeable, leurs rôles et périmètres sont différents. Comprendre cette différence est essentiel pour choisir le bon partenaire en fonction de l’état d’avancement du produit et des objectifs de l’entreprise pharmaceutique.
CDMO définition
Un CDMO est une entreprise qui propose des services intégrés de développement et de fabrication pharmaceutique, allant de la formulation chimique et du développement analytique à la production industrielle selon les normes GMP (Bonnes Pratiques de Fabrication).
Fonctions principales :
- Développement de la pré-formulation, méthodes analytiques, études de stabilité et formulation finale des principes actifs.
- Mise à l’échelle des procédés (du gramme à la tonne) et production de lots cliniques et commerciaux.
- Support réglementaire et transfert de technologie.
- Conditionnement, logistique et gestion de la chaîne d’approvisionnement.
Les CDMO pharma permettent aux laboratoires de réduire les coûts et les risques, d’accélérer le time-to-market, et de se concentrer sur l’innovation en confiant les phases techniques et industrielles à un partenaire fiable.
CMO définition
Un CMO se spécialise dans la fabrication sous contrat, en produisant des médicaments déjà développés, sans intervenir dans la phase de formulation ou de développement technique.
Fonctions principales :
- Fabrication d’API, formes orales solides, liquides, injectables et produits stériles.
- Pré-formulation minimale et exécution de procédés validés, y compris le conditionnement et l’étiquetage.
- Assurance qualité, conformité aux normes GMP et traçabilité.
Les CMO pharma sont particulièrement adaptés aux entreprises qui disposent déjà d’une formulation finalisée et qui ont besoin de capacités de production, de flexibilité industrielle ou d’un accès à des installations certifiées.
Différences principales entre un médicament CMO et CDMO
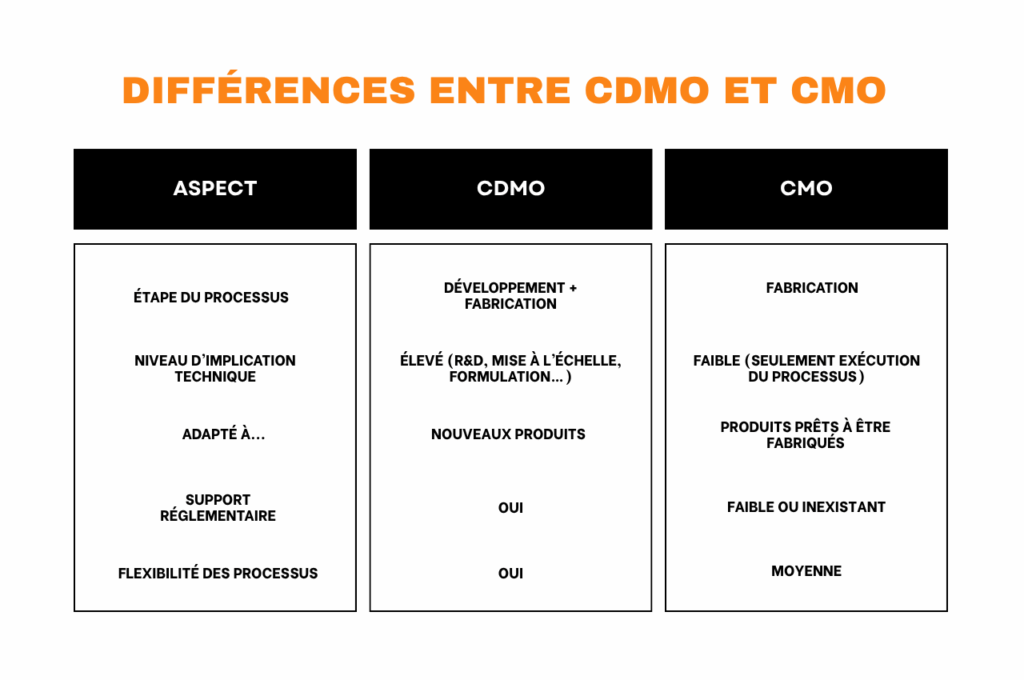
1. Périmètre des services
- CDMO : Offre un service global, du développement préclinique (formulation, optimisation des API, méthodes analytiques) à la fabrication GMP à grande échelle.
- CMO : Se concentre exclusivement sur la fabrication de produits déjà développés, sans participation en R&D.
2. Phase du cycle de vie du médicament
- CDMO : Intervient dès les premières phases, en contribuant à la conception et à l’optimisation des molécules ou des formulations.
- CMO : Intervient dans les phases ultérieures, lors de la production de lots cliniques ou commerciaux.
3. Niveau d’implication technique
- CDMO : Fournit une expertise complète, depuis la recherche jusqu’à la stratégie réglementaire, la gestion des essais cliniques et le transfert de technologie.
- CMO : Exécute uniquement des procédés validés, sans implication dans le développement du produit.
4. Avantages stratégiques
- CDMO : Accélère la mise sur le marché, réduit les risques financiers et évite d’investir dans des infrastructures internes.
- CMO : Offre une capacité de production flexible, sans investissement majeur, idéale pour la fabrication à grande échelle.
5. Transfert technologique et réglementaire
- CDMO : Gère le transfert de technologie, la validation des procédés et l’accompagnement réglementaire pour les essais et l’autorisation de mise sur le marché.
- CMO : Travaille avec des procédés déjà homologués, tout en respectant les normes GMP et les exigences contractuelles du client.
Bonnes pratiques pour garantir la qualité du produit
Le choix du bon partenaire et l’application de bonnes pratiques dès le départ sont essentiels pour garantir la qualité des médicaments, respecter la réglementation et optimiser les délais et les coûts. Voici quelques recommandations clés :
- Validation des capacités techniques : Vérifier l’expérience du prestataire selon le type de produit (oral, injectable, biologique…) et l’échelle de production.
- Conformité réglementaire : Exiger les certifications GMP, la traçabilité documentaire et des systèmes de contrôle qualité robustes.
- Transparence des procédés : Maintenir une communication ouverte, avec des accords clairs de confidentialité et de protection de la propriété intellectuelle.
- Technologies propres et efficaces : Privilégier des solutions comme l’extraction au CO₂ supercritique, notamment en phase de développement, pour obtenir des principes actifs plus purs, durables et conformes aux réglementations européennes.
Dans quels cas AINIA peut agir comme CMO ou CDMO ?
Chez AINIA, nous disposons d’une expérience approfondie dans le développement et la production de principes actifs pharmaceutiques (API), ce qui nous permet d’agir comme CDMO ou CMO, en fonction des besoins spécifiques de chaque client.
- En tant que CDMO, nous proposons des services complets allant de la conception et l’optimisation des API (notamment via des technologies comme l’extraction au CO₂ supercritique), à la montée en échelle, la validation, la caractérisation et le support réglementaire. Une solution idéale en phase de développement initial ou pour répondre aux exigences réglementaires européennes.
- En tant que CMO, nous accompagnons des entreprises disposant déjà de leur formulation, en leur fournissant une capacité de production fiable, conforme aux normes GMP, pour la fabrication de lots pilotes ou industriels.
Grâce à des plateformes comme ALTEX, et à notre capacité d’adaptation aux échelles et aux réglementations, nous proposons des solutions flexibles, durables et innovantes, parfaitement alignées avec les attentes du secteur pharmaceutique.